Immobilisoitu CALB
CALB immobilisoidaan fysikaalisella adsorptiolla erittäin hydrofobiseen hartsiin, joka on makrohuokoinen styreeni/metakrylaattipolymeeri.Immobilisoitu CALB soveltuu käytettäväksi orgaanisissa liuottimissa ja liuotinvapaissa järjestelmissä, ja se voidaan kierrättää ja käyttää uudelleen monta kertaa sopivissa olosuhteissa.
Tuotekoodi: SZ-CALB- IMMO100A, SZ-CALB- IMMO100B.
★ Korkeampi aktiivisuus, korkeampi kiraalinen selektiivisyys ja korkeampi stabiilisuus.
★Parempi suorituskyky ei-vesifaasissa.
★Helppo poistaa reaktiojärjestelmästä, lopettaa reaktiot nopeasti ja välttää proteiinijäämiä tuotteessa.
★ Voidaan kierrättää ja käyttää uudelleen kustannusten alentamiseksi.
| Toiminta | ≥10000PLU/g |
| pH-alue reaktiolle | 5-9 |
| Reaktion lämpötila-alue | 10-60 ℃ |
| Ulkomuoto | CALB-IMMO100-A: Vaaleankeltaisesta ruskeaan kiinteä aine CALB-IMMO100-B: Valkoisesta vaaleanruskeaan kiinteä aine |
| Hiukkaskoko | 300-500 μm |
| Häviö kuivattaessa 105 ℃ | 0,5–3,0 % |
| Hartsi immobilisointiin | Makrohuokoinen, styreeni/metakrylaattipolymeeri |
| Reaktioliuotin | Vesi, orgaaninen liuotin jne. tai ilman liuotinta.Joissakin orgaanisissa liuottimissa tapahtuvaa reaktiota varten voidaan lisätä 3 % vettä reaktiovaikutuksen parantamiseksi |
| Hiukkaskoko | CALB-IMMO100-A: 200-800 μm CALB-IMMO100-B: 400-1200 μm |
Yksikön määritelmä: 1 yksikkö vastaa 1 μmol/min propyylilauraatin synteesiä lauriinihaposta ja 1-propanolista 60 ℃:ssa.Yllä olevat CALB-IMMP100-A ja CALB-IMMO100-B vastaavat immobilisoituja kantoaineita, joilla on eri hiukkaskoot.
1. Reaktorin tyyppi
Immobilisoitu entsyymi soveltuu sekä kattilapanosreaktoriin että kiinteäpetiiseen jatkuvavirtausreaktoriin.On syytä välttää ulkoisen voiman aiheuttamaa murskaamista ruokinnan tai täytön aikana.
2. Reaktion pH, lämpötila ja liuotin
Immobilisoitu entsyymi tulisi lisätä viimeisenä muiden materiaalien lisäyksen ja liuotuksen jälkeen ja pH-säädön jälkeen.
Jos substraatin kuluminen tai tuotteen muodostuminen johtaa pH:n muutokseen reaktion aikana, reaktiojärjestelmään tulee lisätä riittävästi puskuria tai pH:ta on seurattava ja säädettävä reaktion aikana.
CALB:n lämpötilatoleranssialueella (alle 60 ℃) muunnosnopeus kasvoi lämpötilan noustessa.Käytännössä reaktiolämpötila tulisi valita substraatin tai tuotteen stabiilisuuden mukaan.
Yleensä esterihydrolyysireaktio on sopiva vesifaasijärjestelmässä, kun taas esterisynteesireaktio on sopiva orgaanisessa faasijärjestelmässä.Orgaaninen liuotin voi olla etanoli, tetrahydrofuraani, n-heksaani, n-heptaani ja tolueeni tai sopiva liuotinseos.Joissakin orgaanisissa liuottimissa tapahtuvaa reaktiota varten voidaan lisätä 3 % vettä reaktiovaikutuksen parantamiseksi.
3. CALB:n uudelleenkäyttö ja käyttöikä
Sopivissa reaktio-olosuhteissa CALB voidaan ottaa talteen ja käyttää uudelleen, ja erityiset käyttöajat vaihtelevat eri projektien mukaan.
Jos talteen otettua CALB:tä ei käytetä uudelleen jatkuvasti ja se on varastoitava talteenoton jälkeen, se on pestävä ja kuivattava ja suljettava 2-8 ℃:ssa.
Useiden uudelleenkäyttökierrosten jälkeen, jos reaktion tehokkuus on hieman heikentynyt, CALB voidaan lisätä asianmukaisesti ja jatkaa käyttöä.Jos reaktioteho heikkenee vakavasti, se on vaihdettava.
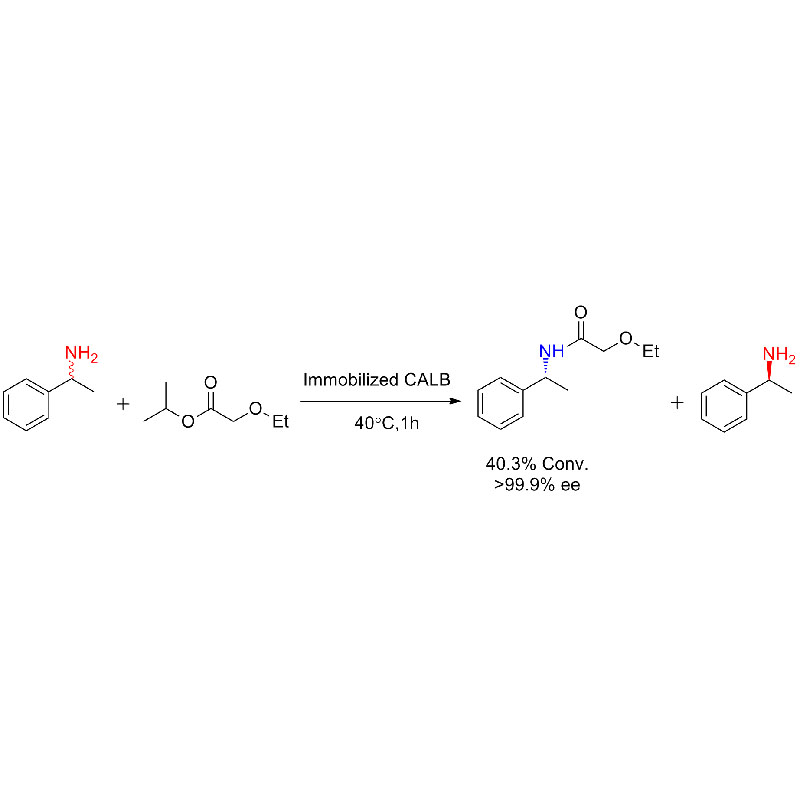
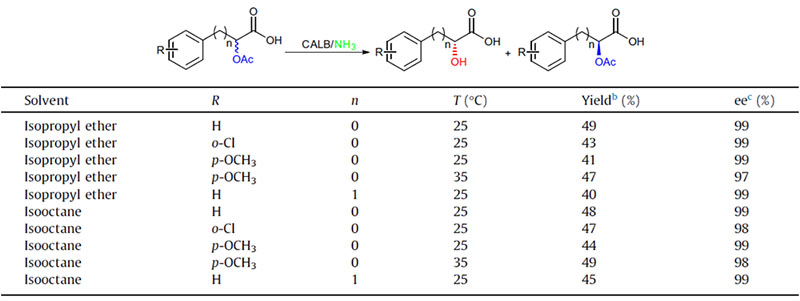
Esimerkki 1 (Aminolyysi)(1):
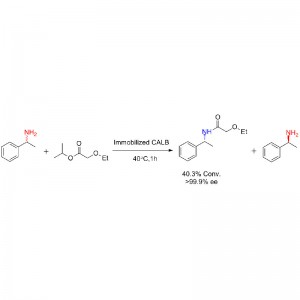
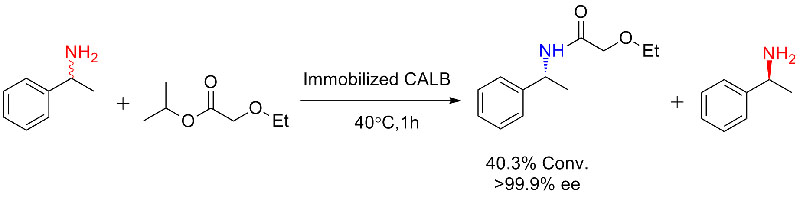
Esimerkki 2 (Aminolyysi)(2):
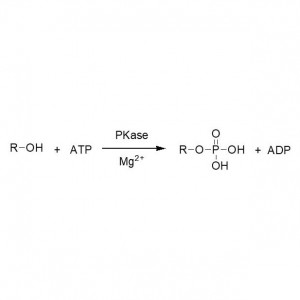
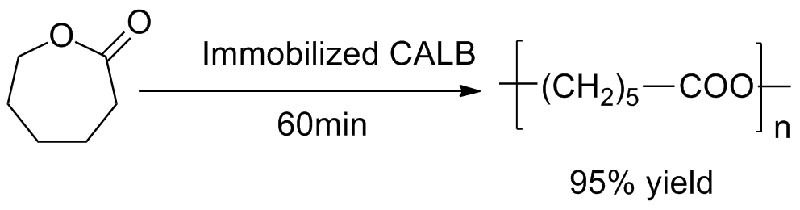
Esimerkki 3 (Renkaan avautuva polyesterisynteesi)(3):
Esimerkki 4 (transesteröinti, hydroksyyliryhmän regioselektiivinen)(4):
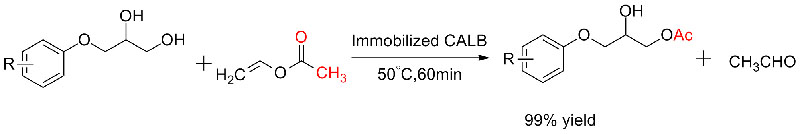
Esimerkki 5 (transesteröinti, raseemisten alkoholien kineettinen erottelu)(5):
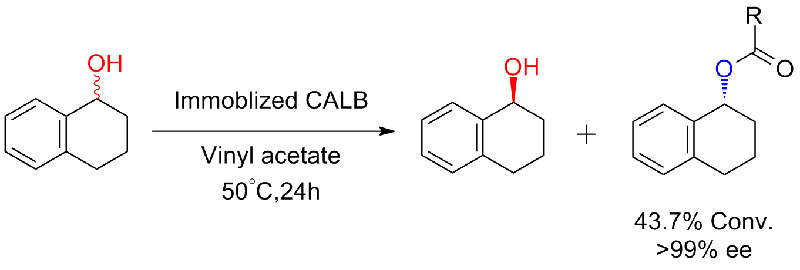
Esimerkki 6 (esteröinti, karboksyylihapon kineettinen erottelu)(6):
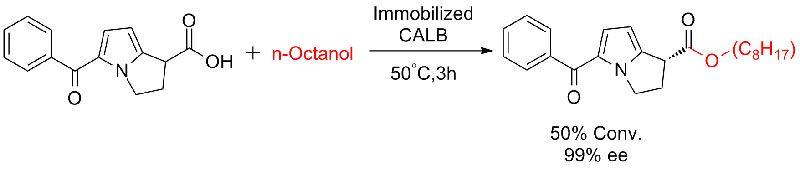
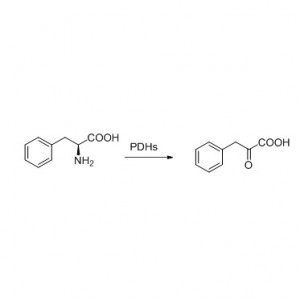
Esimerkki 7 (Esterolyysi, kineettinen erotuskyky)(7):
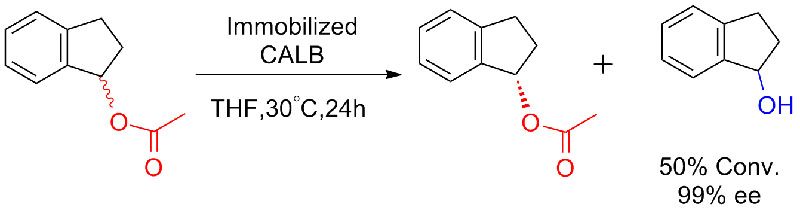
Esimerkki 8 (Amidien hydrolyysi)(8):
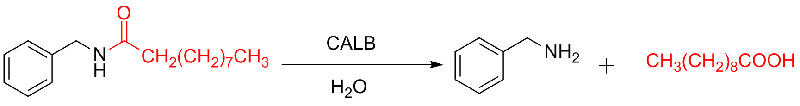
Esimerkki 9 (Amiinien asylointi)(9):
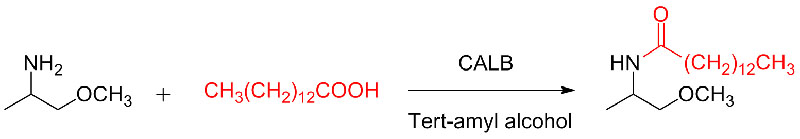

Esimerkki 10 (Aza-Michael-additioreaktio)(10):
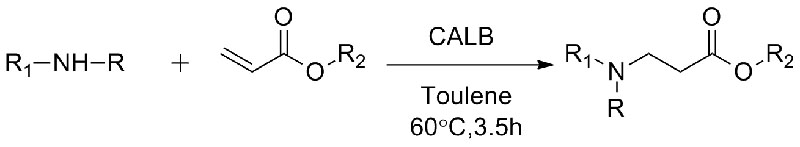
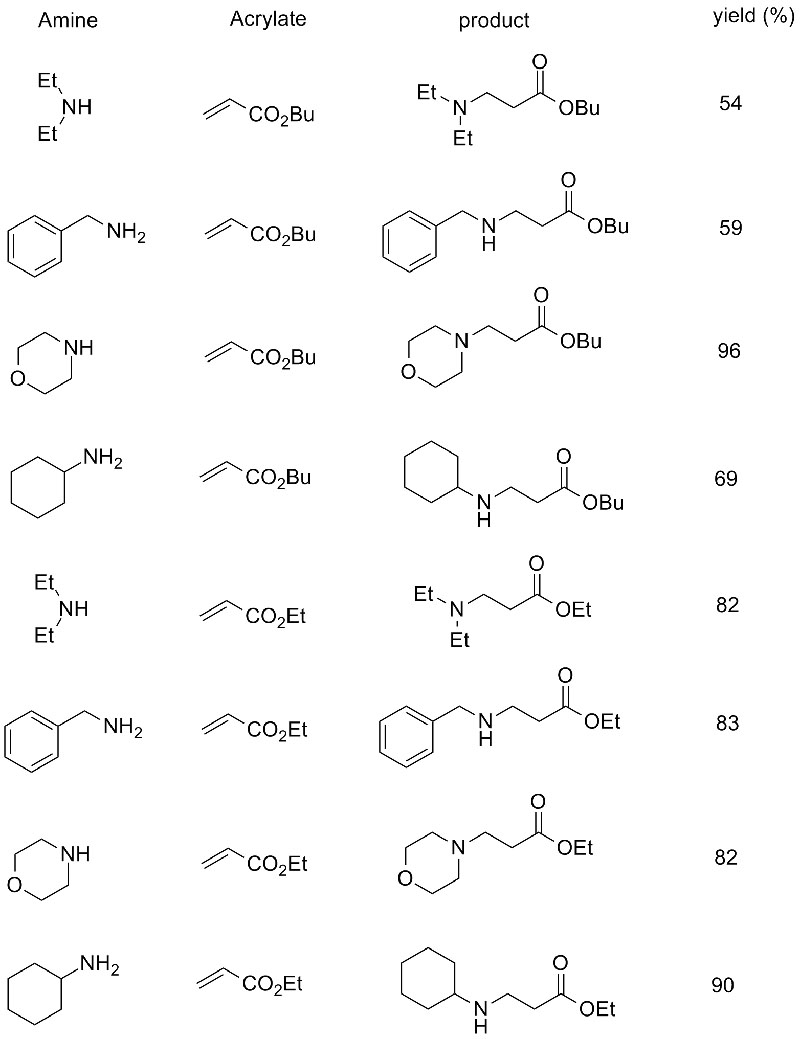
1. Chen S, Liu F, Zhang K, et tal.Tetrahedron Lett, 2016, 57: 5312-5314.
2. Olah M, Boros Z, anszky GH, et tal.Tetrahedron, 2016, 72: 7249-7255.
3. Nakaoki1 T, Mei Y, Miller LM, et tal.Ind. Biotechnol, 2005, 1(2):126-134.
4. Pawar SV, Yadav G DJ Ind. Eng.Chem, 2015, 31: 335-342.
5. Kamble MP, Shinde SD, Yadav G DJ Mol.Catal.B: Enzym, 2016, 132: 61-66.
6. Shinde SD, Yadav G D. Process Biochem, 2015, 50: 230-236.
7. Souza TC, Fonseca TS, Costa JA, ym.J. Mol.Catal.B: Enzym, 2016, 130: 58-69.
8. Gavil´an AT, Castillo E, L´opez-Mungu´AJ Mol.Catal.B: Enzym, 2006, 41: 136-140.
9. Joubioux FL, Henda YB, Bridiau N, et tal.J. Mol.Catal.B: Enzym, 2013, 85-86: 193-199.
10. Dhake KP, Tambade PJ, Singhal RS, et tal.Tetrahedron Lett, 2010, 51: 4455-4458.